新聞中心
來源:國家藥監局
2018年,國家藥品監督管理局藥品審評中心(以下簡稱藥審中心)在國家藥品監督管理局(以下簡稱國家局)堅強領導下,繼續貫徹落實中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42号,以下簡稱42号文件)和國務院《關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44号,以下簡稱44号文件)精神,按照4月12日和6月20日國務院常務會議要求,在鼓勵藥物研發創新、提高藥品質量、保障人民用藥安全有效可及等方面開展了一系列工作,以高度的責任感和使命感持續深化藥品審評審批制度改革,堅持依法依規、科學規範審評,堅決維護和促進公衆健康。
一、藥品注冊申請受理情況
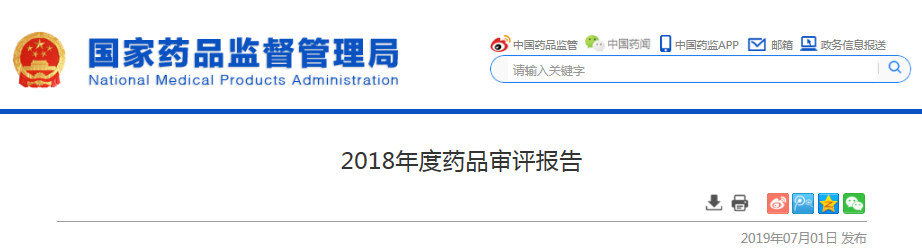
2018年,藥審中心受理新注冊申請共7336件(以受理号計,下同),其中需技術審評的注冊申請5574件,直接行政審批(無需技術審評,下同)的注冊申請1762件。與2017年相比,2018年藥審中心需技術審評的注冊申請任務受理量大幅增長(較2017年增長了47%),且中藥、化藥和生物制品各類藥品注冊申請任務受理量均有較大幅度增長(較2017年分别增長了30%、50%和42%)。
2018年,藥審中心受理1類創新藥注冊申請共264個品種(涉及533件受理号,化藥的品種數以活性成分統計,中藥和生物制品的品種數均以藥品通用名稱統計,下同),較2017年增長了21%。其中,受理1類創新藥的新藥臨床試驗(IND)申請239個品種,較2017年增長了15%;受理1類創新藥的新藥上市申請(NDA)25個品種,較2017年增長了150%。
2018年,藥審中心受理1類化藥創新藥注冊申請共157個品種,其中,受理1類化藥創新藥NDA16個品種,較2017年增長了100%。
2018年,藥審中心受理1-6類中藥新藥注冊申請共37個品種,其中,受理中藥NDA8個品種,較2017年增長了7倍;受理中藥IND29個品種,且有1個品種為1類中藥創新藥IND申請。
2018年,藥審中心受理1類生物制品創新藥注冊申請106個品種(包括預防用生物制品6件,治療用生物制品117件,共涉及123件受理号),較2017年增長了62%。其中,受理1類生物制品NDA9個品種(包括預防用生物制品2件,治療用生物制品9件,共涉及11件受理号),較2017年增長了4.5倍。
(一)總體情況
2018年,藥審中心受理的7336件新注冊申請中,化藥注冊申請受理量為5979件,占2018年全部注冊申請受理量的82%,2018年各類藥品注冊申請受理情況與近三年比較詳見圖1。
需技術審評的5574件注冊申請中,化藥為4459件,占全部需技術審評的注冊申請受理量的80%,中藥和生物制品注冊申請分别為300件和815件。
(二)國産創新藥受理情況
藥審中心受理國産1類創新藥注冊申請448件(涉及222個品種),其中受理臨床申請403件(涉及198個品種),上市申請45件(涉及24個品種)。按藥品類型統計,化藥323件(涉及115個品種),中藥2件(涉及1個品種),生物制品123件(涉及106個品種),創新藥的适應症主要集中在抗腫瘤、内分泌系統和消化系統領域。
(三)進口藥受理情況
藥審中心受理5.1類化藥進口原研藥注冊申請75件(涉及50個品種),受理1類進口創新藥注冊申請85件(涉及42個品種),創新藥的适應症主要集中在抗腫瘤、循環系統和消化系統領域。
(四)各類注冊申請受理情況
1.化藥注冊申請受理情況
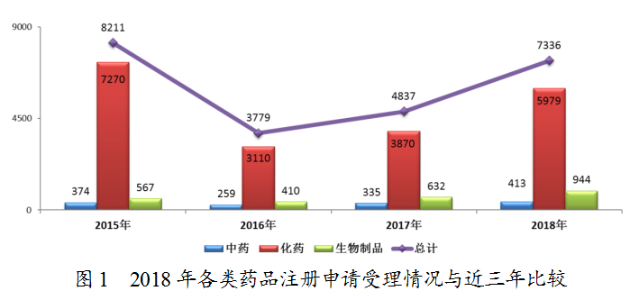
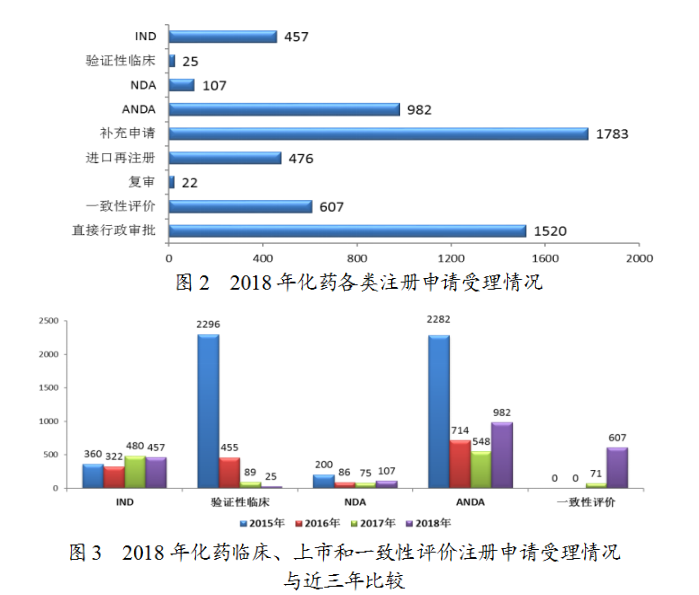
藥審中心受理化藥注冊申請共5979件,其中受理化藥NDA申請107件,較2017年增長了43%;受理仿制藥上市申請(ANDA)982件,較2017年增長了79%。化藥各類注冊申請受理情況詳見圖2。2018年化藥臨床、上市和一緻性評價注冊申請受理情況與近三年比較詳見圖3。
(1)創新藥受理情況
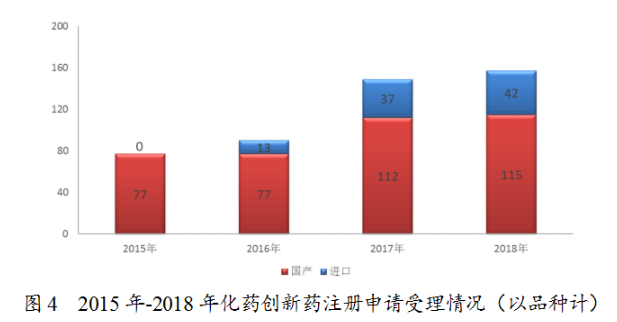
藥審中心受理1類化藥創新藥注冊申請157個品種,整體較2017年略有增加,其中受理創新藥NDA16個品種,較2017年增長了一倍。2018年受理的157個化藥創新藥注冊申請中,國産化藥創新藥注冊申請為115個品種,進口化藥創新藥注冊申請為42個品種,2015年至2018年創新藥注冊申請受理情況詳見圖4。
(2)化藥新藥臨床試驗申請适應症
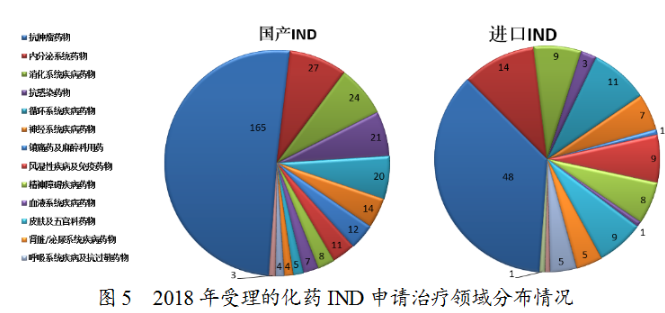
藥審中心受理化藥IND申請457件,其中受理國産化藥IND申請325件,受理進口IND申請132件。國産化藥IND申請的适應症主要集中在抗腫瘤、内分泌系統和消化系統領域。進口IND申請的适應症主要集中在抗腫瘤、内分泌系統和循環系統領域,具體治療領域分布詳見圖5。
2.中藥注冊申請受理情況
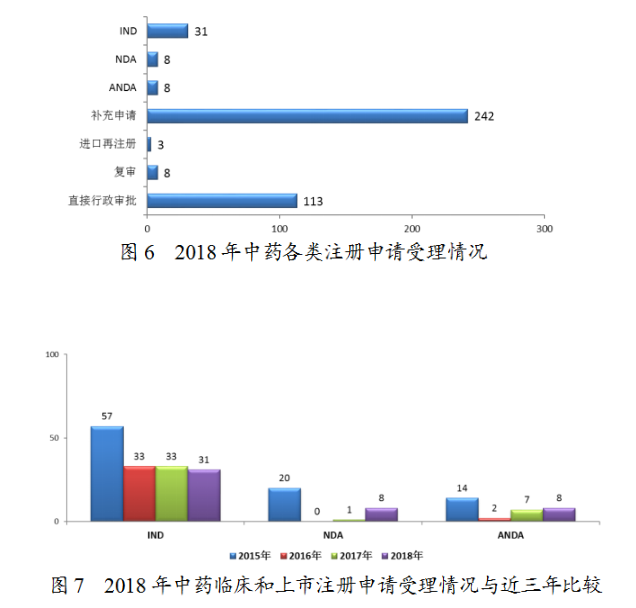
藥審中心受理中藥注冊申請413件,其中受理中藥IND申請31件,受理中藥NDA8件,受理中藥ANDA8件。中藥各類注冊申請受理情況詳見圖6。2018年中藥臨床和上市注冊申請受理情況與近三年比較詳見圖7。
(1)中藥新藥受理情況
藥審中心受理1-6類中藥新藥注冊申請39件,其中受理中藥NDA8件(涉及8個品種),較2017年增長了7倍;中藥IND31件(涉及29個品種),其中1類中藥創新藥IND申請有2件(涉及1個品種)。
(2)中藥新藥臨床試驗申請适應症
藥審中心受理中藥IND申請31件,主要治療領域為消化、心血管、呼吸和精神神經,占全部中藥IND申請的65%。
3.生物制品注冊申請受理情況
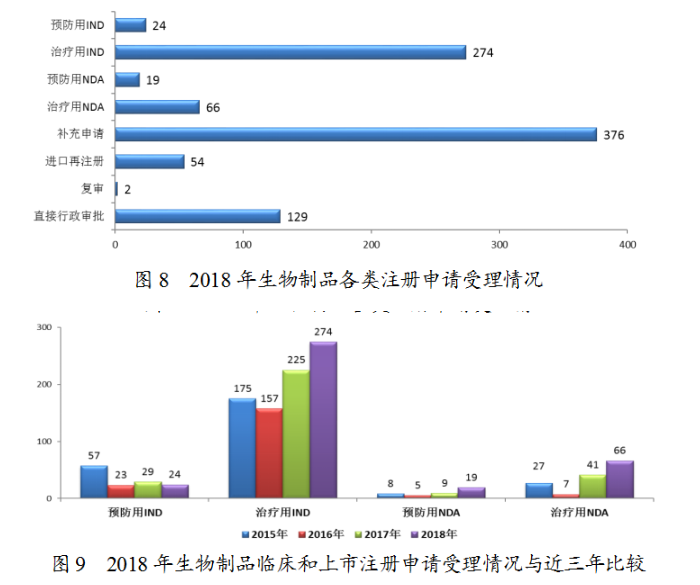
藥審中心受理生物制品注冊申請944件,其中受理生物制品IND申請298件;受理生物制品NDA85件,較2017年增長了70%。生物制品各類注冊申請受理情況詳見圖8。2018年生物制品臨床和上市注冊申請受理情況與近三年比較詳見圖9。
(1)1類生物制品創新藥受理情況
藥審中心受理1類生物制品創新藥注冊申請123件(包括預防用生物制品6件,治療用生物制品117件),較2017年增長了62%。其中,受理1類生物制品NDA11件(包括預防用生物制品2件,治療用生物制品9件,共涉及9個品種),較2017年增長了4.5倍;受理1類生物制品IND112件(包括預防用生物制品4件,治療用生物制品108件,共涉及97個品種),較2017年增長了51%。
(2)1類治療用生物制品創新藥臨床試驗申請适應症
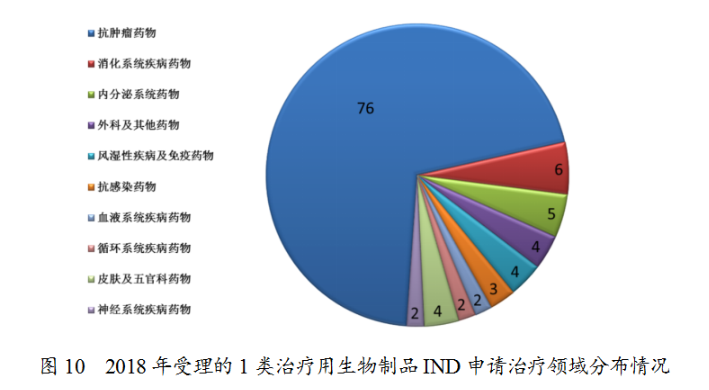
藥審中心受理1類治療用生物制品IND申請108件(涉及93個品種),适應症主要集中在抗腫瘤治療領域,占全部1類治療用生物制品IND申請的70%,具體治療領域分布詳見圖10。
二、藥品注冊申請審評審批情況
(一)審評審批總體完成情況
1.全年審評審批完成情況
2018年底,藥審中心實現中藥、化藥、生物制品各類注冊申請按時限審評審批率已超過90%,基本完成了44号文件确定2018年實現按規定時限審批的工作目标。全年完成審評審批的注冊申請共9796件,其中完成需技術審評的注冊申請7988件(包含4052件需技術審評的行政審批任務),完成直接行政審批的注冊申請1808件。
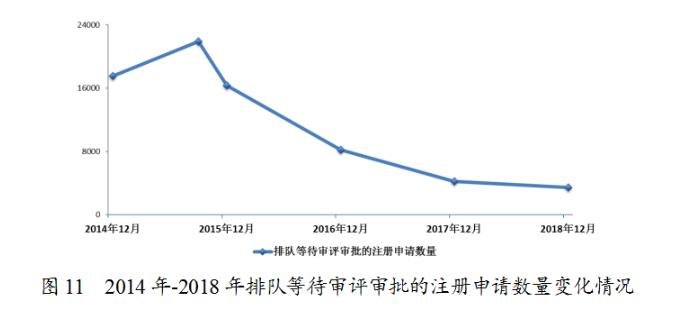
2018年底排隊等待審評審批的注冊申請已由2015年9月高峰時的近22000件降至3440件(不含完成審評因申報資料缺陷等待申請人回複補充資料的注冊申請),進一步鞏固了44号文件要求解決注冊申請積壓的成效。2014年-2018年排隊等待審評審批的注冊申請數量變化情況詳見圖11。
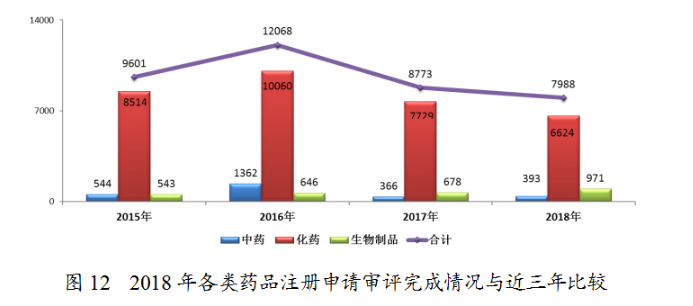
完成審評的申請中,化藥注冊申請為6624件,約占全部審評完成量的83%。2018年各類藥品注冊申請審評完成情況與近三年比較詳見圖12。
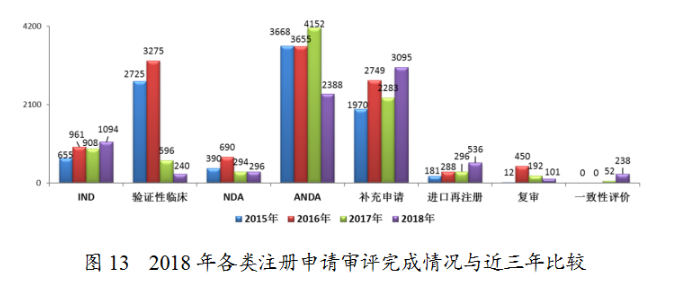
2.各類注冊申請審評完成情況
藥審中心完成IND申請審評1094件,完成NDA審評296件,完成ANDA審評2388件,2018年各類注冊申請審評完成情況與近三年比較詳見圖13。
3.審評通過情況
2018年,藥審中心審評通過批準IND申請947件,審評通過(往年的年度審評報告中表述為“審評通過建議批準”,下同)NDA175件,審評通過ANDA1038件。
審評通過上市1類創新藥9個品種,審評通過進口原研藥67個品種,具體品種詳見附件1、2。
(二)化藥注冊申請審評完成情況
1.總體情況
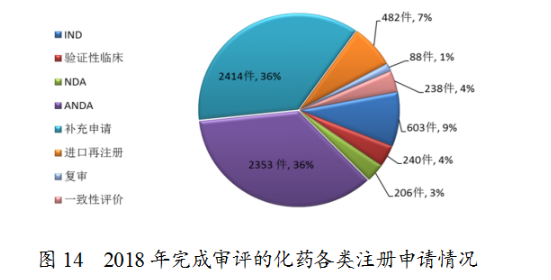
藥審中心完成審評的化藥注冊申請6624件,其中完成化藥臨床申請(IND和驗證性臨床)共843件,完成化藥NDA206件,完成化藥ANDA2353件。完成審評的化藥各類注冊申請情況詳見圖14。
2.審評通過情況
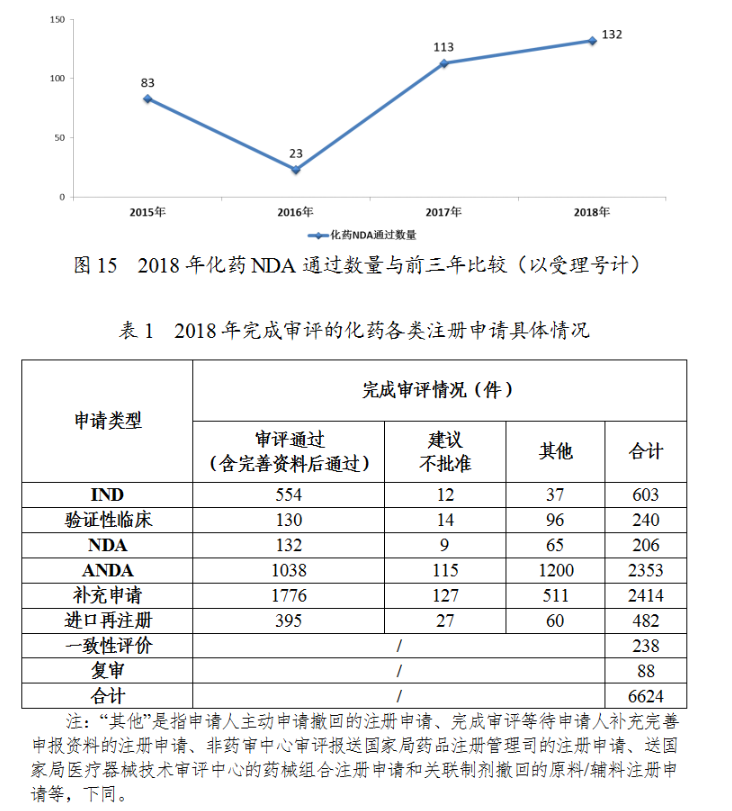
藥審中心完成審評的化藥NDA206件,其中審評通過132件,與前三年比較(以受理号計)詳見圖15,2018年完成審評的化藥各類注冊申請具體情況詳見表1。
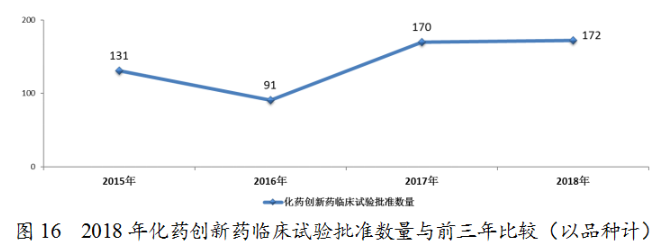
藥審中心完成審評的化藥IND申請603件,審評通過批準IND申請554件,其中批準1類創新藥臨床試驗申請449件(涉及172個品種)。1類化藥創新藥臨床試驗批準數量與前三年比較(以品種計)詳見圖16。
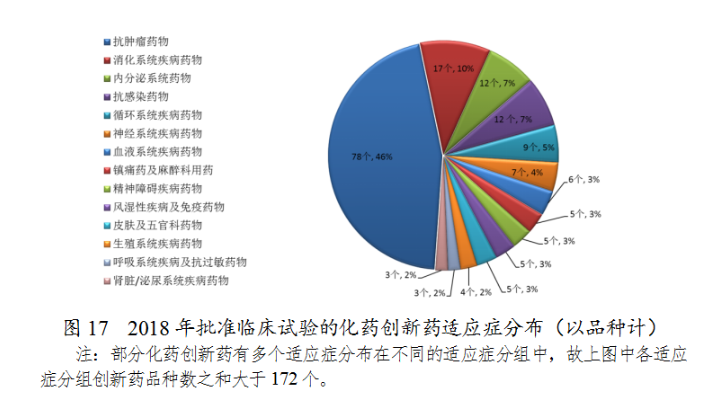
藥審中心審評通過批準創新藥臨床試驗的172個品種中,抗腫瘤藥物、消化系統藥物、内分泌系統藥物和抗感染藥物較多,占全部創新藥臨床試驗批準數量的68%。批準臨床試驗的化藥創新藥适應症分布(以品種計)詳見圖17。
(三)中藥注冊申請審評完成情況
1.總體情況
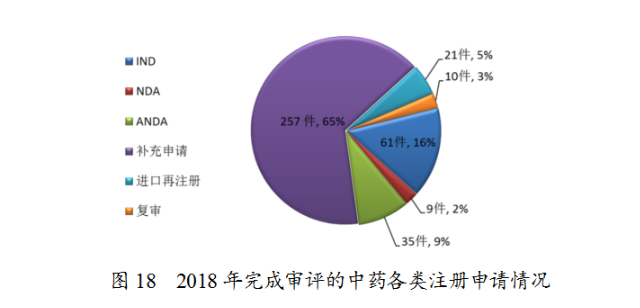
藥審中心完成審評的中藥注冊申請393件,其中完成IND申請61件,完成NDA9件,完成ANDA35件。完成審評的中藥各類注冊申請情況詳見圖18。
2.審評通過情況
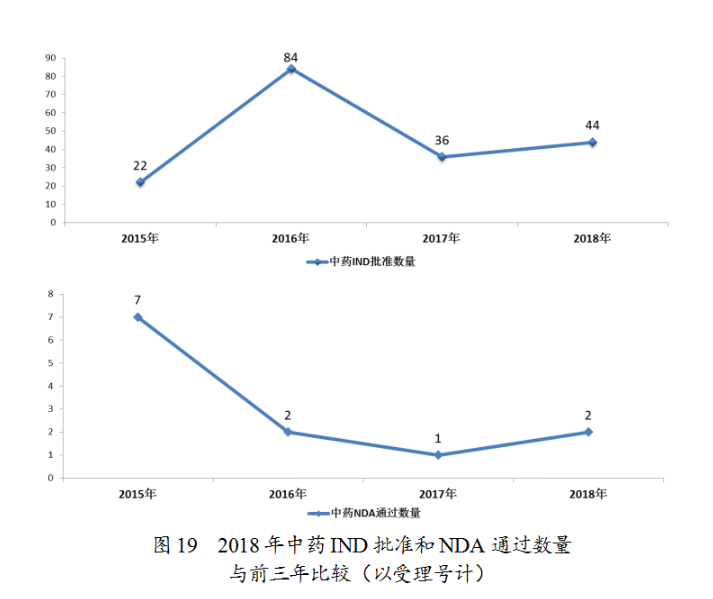
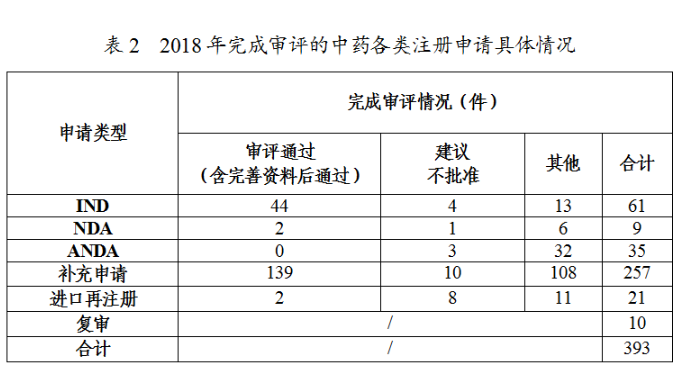
藥審中心審評通過批準中藥IND申請44件;審評通過中藥NDA2件(涉及2個品種,關黃母顆粒、金蓉顆粒)。完成審評的中藥各類注冊申請具體情況詳見表2,中藥IND批準和NDA通過量與前三年比較(以受理号計)詳見圖19。
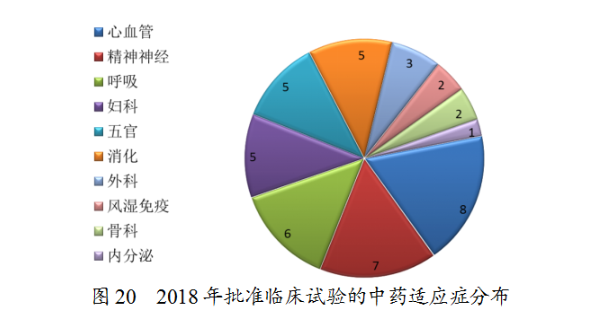
藥審中心審評通過批準臨床試驗的中藥IND申請44件,涉及10個适應症領域,其中心血管、精神神經、呼吸較多,共占48%,具體治療領域分布詳見圖20。
(四)生物制品注冊申請審評完成情況
1.總體情況
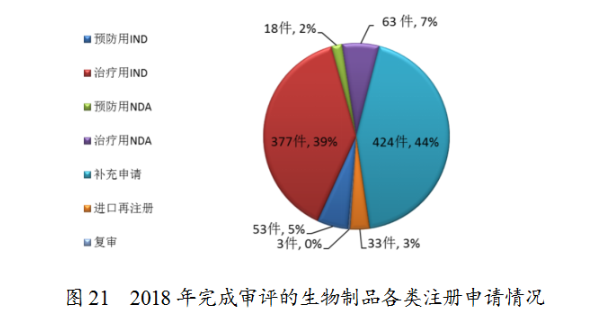
藥審中心完成審評的生物制品注冊申請共971件,其中完成預防用生物制品IND申請(預防用IND)53件,完成治療用生物制品IND申請(治療用IND)377件,完成預防用生物制品NDA(預防用NDA)18件,完成治療用生物制品NDA(治療用NDA)63件。完成審評的生物制品各類注冊申請情況詳見圖21。
2.審評通過情況
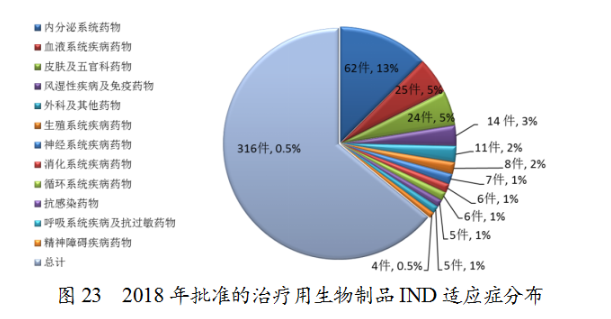
藥審中心審評通過批準預防用IND33件,批準治療用IND316件;審評通過預防用NDA11件、治療用NDA30件。2018年完成審評的生物制品各類注冊申請具體情況詳見表3,生物制品IND批準和NDA通過量與前三年比較(以受理号計)詳見圖22。
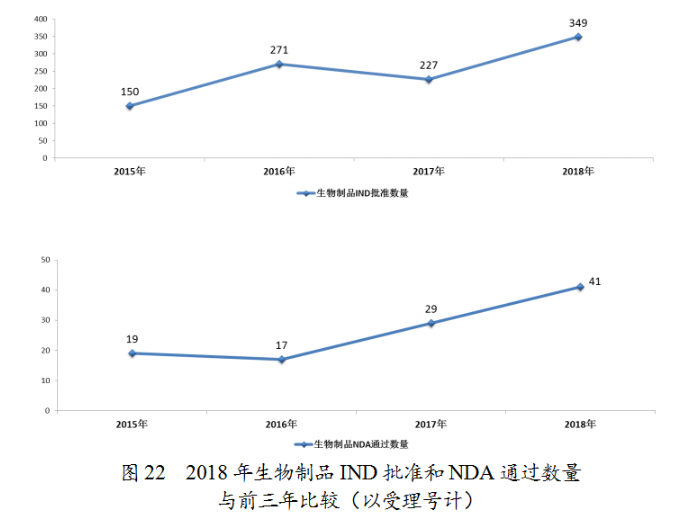
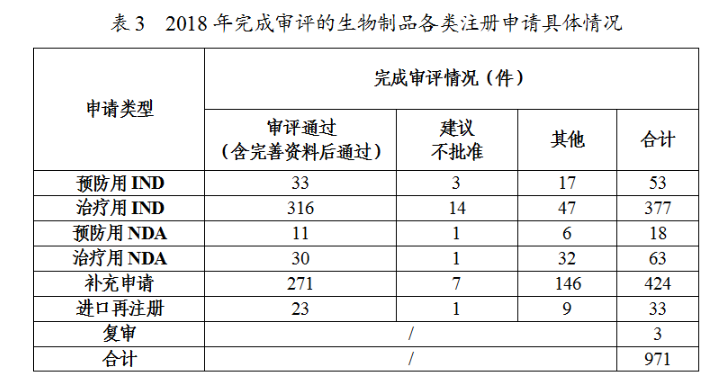
藥審中心審評通過批準生物制品IND349件,其中批準的治療用生物制品IND治療領域分布詳見圖23。
(五)行政審批任務完成情況
2018年,藥審中心共完成行政審批任務5860件,其中,完成無需技術審評的直接行政審批任務(即無需技術審評的補充申請)1808件,平均審批時限為12.3個工作日,遠小于法定的20日行政審批時限,其中有1656件任務在法定的20日時限内完成,全年平均按時限完成率為92%;完成需技術審評品種的行政審批任務(即臨床申請、進口再注冊申請、需技術審評的補充申請等)4052件,平均審批時限為18.6個工作日,小于法定的20日行政審批時限,全年平均按時限審批完成率為84%。(注:上述4052件需技術審評的行政審批任務,不包括原輔包關聯審評審批實施前已受理完成審評後轉原輔包登記平台管理的注冊申請任務)。
(六)優先審評納入情況
1.優先審評品種納入情況
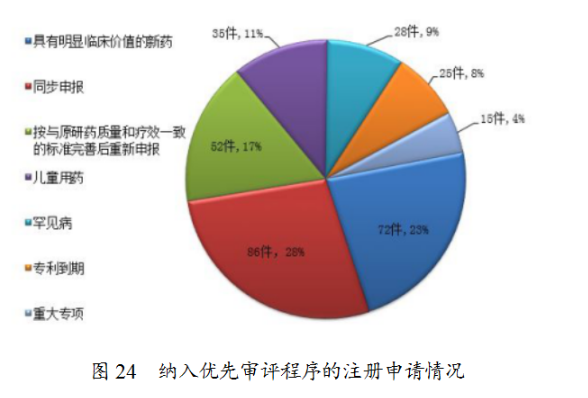
根據國家食品藥品監督管理總局(以下簡稱原總局)《關于鼓勵藥品創新實行優先審評審批的意見》(食藥監藥化管〔2017〕126号),2018年,藥審中心共将313件注冊申請納入優先審評程序,其中兒童用藥和罕見病用藥63件。2018年納入優先審評的注冊申請中,同步申報的品種占比最大,占比為28%,其次為具有明顯臨床價值的新藥,占比為23%。納入優先審評程序的注冊申請情況詳見圖24。
2.優先審評品種審評完成情況
2018年,共有83個品種通過優先審評程序得以加快批準上市(以通用名計算),如自主研發的注射用艾博韋泰、口服丙肝治療用新藥達諾瑞韋鈉片、治療晚期結直腸癌的小分子血管生成抑制劑呋喹替尼膠囊等藥品,具體品種名單詳見附件3。
(七)溝通交流情況
1.溝通交流總體情況
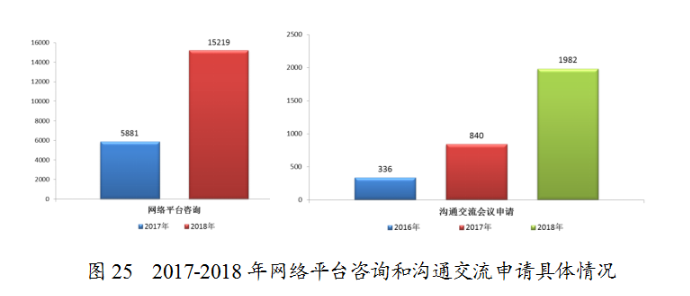
為進一步為申請人提供便利,藥審中心不斷豐富溝通交流渠道,提高溝通交流效率和質量,形成了溝通交流會議、網絡平台咨詢(一般性技術問題)、電話咨詢、郵件咨詢和現場咨詢的多渠道、多層次的溝通交流模式。2018年藥審中心接收溝通交流申請1982件,較2017年的840件增長了136%;接收網絡平台咨詢15219個,較2017年的5881個增長了159%,電話咨詢超過上萬次,郵件咨詢數千次,同時每周三定期開展現場咨詢。2017至2018年網絡平台咨詢和溝通交流申請具體情況見圖25。
2.溝通交流會召開情況
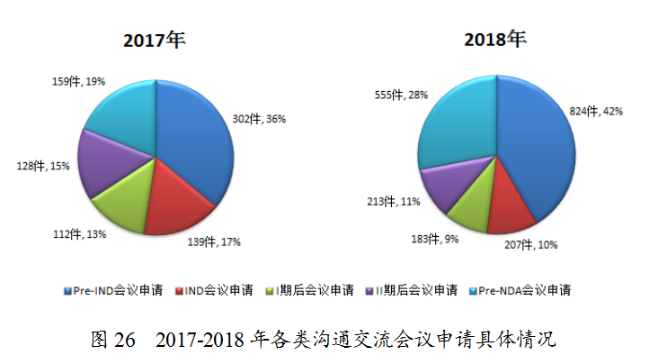
2018年收到溝通交流會議申請1982件,其中Pre-IND會議申請和Pre-NDA會議申請占比例較多,分别為42%和28%。與2017年比較,Pre-IND會議申請和Pre-NDA會議申請所占比例增長較明顯,2017至2018年各類溝通交流會議申請具體情況見圖26。
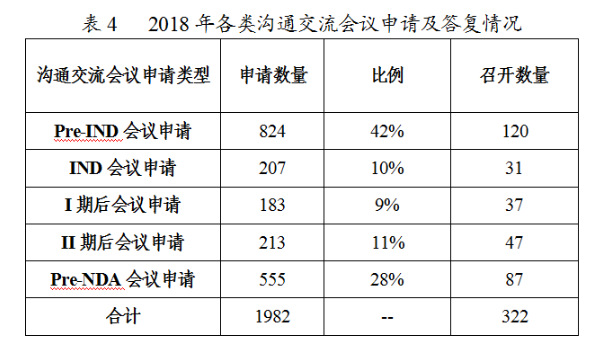
根據申請人拟溝通的問題及提交的支持性材料,經審核評估,2018年藥審中心召開溝通交流會322次,其餘均以書面形式進行了答複,2018年各類溝通交流會議申請及答複情況詳見表4。
三、鼓勵創新與保障公衆用藥情況
(一)加快審評重點品種
2018年,藥審中心在進一步鞏固解決注冊申請積壓成效和基本實現各類藥品注冊申請按法定時限審評審批的基礎上,通過實施優先審評程序、加強與申請人的溝通交流等措施,一批具有明顯臨床價值、臨床急需等新藥好藥通過技術審評,為患者提供了更多用藥選擇。
2018年,藥審中心審評通過的新藥(NDA及IND直接批産)106個(按品種統計),包含關黃母顆粒、金蓉顆粒2個新中藥複方制劑,以及9個1類創新藥和67個進口原研藥(詳見附件1、2)。1類創新藥全部為我國自主創新藥品且以抗癌藥、抗病毒藥居多,分别是呋喹替尼膠囊、羅沙司他膠囊、馬來酸吡咯替尼片、鹽酸安羅替尼膠囊、達諾瑞韋鈉片、注射用艾博韋泰6個化學新分子實體藥物,特瑞普利單抗注射液、信迪利單抗注射液2個抗PD-1單克隆抗體,以及重組細胞因子基因衍生蛋白注射液。
2018年藥審中心審評通過的重點品種有:
抗腫瘤藥物:
1.呋喹替尼膠囊,為具有自主知識産權的國産小分子多靶點抗血管生成藥物,适用于治療經過含氟尿嘧啶和鉑類化療後進展的晚期結直腸癌,該藥品為晚期腸癌患者提供了更好的治療手段。
2.鹽酸安羅替尼膠囊,為具有自主知識産權的國産小分子多靶點抗血管生成藥物,适用于治療既往經過兩種系統方案化療後出現進展或複發的晚期非小細胞肺癌,該藥品為晚期肺癌患者提供了新的治療選擇。
3.馬來酸吡咯替尼片,為具有自主知識産權的國産人表皮生長因子受體2(HER-2)小分子酪氨酸激酶抑制劑,适用于治療HER-2陽性轉移性乳腺癌,該藥品滿足了HER-2陽性晚期乳腺癌患者迫切的臨床需求。
4.特瑞普利單抗注射液,為具有自主知識産權的國産首個新型抗腫瘤藥物抗PD-1單克隆抗體,适用于治療既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤,該藥品滿足了晚期黑色素瘤患者迫切的臨床需求。
5.信迪利單抗注射液,為具有自主知識産權的國産首個适用于治療至少經過二線系統化療的複發或難治性經典型霍奇金淋巴瘤的新型抗腫瘤藥物抗PD-1單克隆抗體。目前,全球同類産品有納武利尤單抗注射液和帕博利珠單抗注射液,我國批準用于治療非小細胞肺癌、黑色素瘤,但尚未批準其用于治療淋巴瘤,該藥品滿足了國内患者的臨床需求。
6.帕博利珠單抗注射液,為新型抗腫瘤藥物抗PD-1單克隆抗體,适用于治療一線治療失敗後不可切除或轉移性黑色素瘤,該藥品為晚期黑色素瘤患者提供了新的治療手段。
7.納武利尤單抗注射液,為國内首個新型抗腫瘤藥物抗PD-1單克隆抗體,适用于治療經過含鉑化療後疾病進展的轉移性非小細胞肺癌,該藥品為晚期肺癌患者提供了更優的治療選擇。
8.鹽酸阿來替尼膠囊,為第二代小分子ALK抑制劑,适用于治療ALK融合基因陽性的轉移性非小細胞肺癌。該藥品與現有标準治療相比,具有顯著的生存獲益(無進展生存期從11個月提高到34.8個月),為ALK陽性晚期肺癌患者提供了突破性的治療選擇。
抗感染藥物:
9.索磷布韋維帕他韋片,為國内首個第三代泛基因型直接抗慢性丙型肝炎病毒(HCV)感染的口服複方制劑,适用于治療基因1至6型、混合型和未知型HCV感染,治愈率高達98%。該藥品已入選國家基本藥物目錄,為我國徹底消滅慢性丙型肝炎提供了有力武器。
10.來迪派韋索磷布韋片,為第二代直接抗HCV感染口服複方制劑,具有廣譜抗HCV病毒作用,适用于治療基因1、4、5、6型HCV感染,該藥品為我國慢性丙型肝炎患者提供更多的治愈機會。
11.達諾瑞韋鈉片,為具有自主知識産權的國産首個抗HCV口服制劑,适用于與其他藥物聯合使用,治療初治的非肝硬化的基因1型慢性丙型肝炎。該藥品填補了國内該領域的空白,可降低用藥成本,滿足HCV患者用藥可及性。
12.注射用艾博韋泰,為具有自主知識産權的國産首個抗艾滋病藥物,适用于與其它藥物聯合使用,治療已接受過抗病毒藥物治療的人類免疫缺陷病毒-1(HIV-1)感染。該藥品上市填補了國内該領域的空白,為艾滋病患者提供了新的安全有效的治療選擇。
13.泊沙康唑腸溶片,為咪唑類抗真菌藥物,适用于預防13歲和13歲以上患者因重度免疫缺陷而導緻侵襲性曲黴菌和念珠菌感染風險增加。目前,深部真菌感染已成為導緻癌症、造血幹細胞移植、艾滋病等免疫系統受損患者死亡的主要原因,該藥品為深部真菌感染的預防與治療提供了新的選擇。
循環系統藥物:
14.甲苯磺酸艾多沙班片,為新型抗凝藥物,适用于預防伴有一個或多個風險因素的非瓣膜性房顫患者的卒中和體循環栓塞,以及治療深靜脈血栓和肺栓塞以及預防其複發。該藥品與現有治療手段相比,可降低出血風險,為上述患者提供了更優的治療選擇。
15.依洛尤單抗注射液,為國内首個遺傳性罕見病純合子型家族性高膽固醇血症(HoFH)單克隆抗體,适用于與飲食療法和其他藥物聯合使用治療HoFH,降低密度脂蛋白膽固醇(LDL-C)。現有降脂療法不能有效降低LDL-C,該藥品為常規治療療效不佳或者不耐受的血脂異常患者提供了新的治療手段。
16.司來帕格片,為國内首個肺動脈高壓(PAH)前列環素類口服制劑,适用于治療PAH以延緩疾病進展及降低因PAH而住院的風險。目前,PAH仍是一種嚴重威脅生命的疾病,國内可選擇的特異性治療藥物很少,該藥品與同類藥物相比,在給藥方式和耐受性方面更具優勢,滿足了肺動脈高壓患者迫切的臨床需求。
血液系統藥物:
17.依庫珠單抗注射液,為補體蛋白C5特異性抗體,适用于治療罕見病陣發性睡眠性血紅蛋白尿症(PNH)和非典型溶血性尿毒症綜合征(aHUS)。該藥品是全球唯一獲批治療PNH溶血的藥物,為挽救aHUS患者的生命帶來突破性改變,屬于臨床急需産品,對于改善我國PNH和aHUS患者的生存現狀具有重大意義。
18.羅沙司他膠囊,為全球首個獲批上市具有自主知識産權的國産低氧誘導因子脯氨酸羟化酶(HIF-PH)抑制劑,适用于治療正在接受透析治療的患者因慢性腎髒病引起的貧血。該藥品具有全新作用機制,與現有常規治療藥物相比,可口服給藥,在提高鐵利用率、無需靜脈補鐵等方面具有臨床優勢。
神經系統藥物:
19.拉考沙胺片,為新型抗癫痫藥物,适用于16歲及以上癫痫患者部分性發作的聯合治療。該藥品與傳統抗癫痫藥物相比,具有耐藥性良好、有效性高、不良反應少的特點,可滿足癫痫患者的臨床需求。
20.特立氟胺片,為抑制T細胞增殖的新型口服免疫調節劑,适用于治療複發型多發性硬化症。多發性硬化症是一種終身、慢性、進展性的自身免疫性罕見病,導緻中樞神經系統的功能性障礙,該藥品與傳統治療藥物相比,耐受性良好,為多發性硬化症患者提供了更優選擇。
預防用生物制品(疫苗):
21.九價人乳頭瘤病毒疫苗(釀酒酵母),适用于預防所包含HPV型别引起的宮頸癌、癌前病變、不典型病變以及持續感染,該藥品滿足了中國女性對九價HPV疫苗的臨床需求。目前全球已上市使用的所有HPV疫苗品種在我國均有供應,能更好地滿足公衆對疫苗接種的不同需求,為宮頸癌的預防提供了新的有效手段。
中藥新藥:
22.關黃母顆粒,為新的中藥複方制劑,适用于治療更年期綜合征肝腎陰虛證。與已上市的中藥相比,該藥品在改良Kupperman量表評分的改善等有效性方面有一定臨床優勢,為更年期綜合征女性患者的臨床治療提供了一種更為安全有效的治療選擇。
23.金蓉顆粒,為新的中藥複方制劑,适用于治療乳腺增生病痰瘀互結沖任失調證。該藥品為乳腺增生病患者提供了一種新的中醫證型的安全有效治療手段,對于滿足患者需求和解決臨床可及性具有積極意義。
重大公共衛生用藥:
24.四價流感病毒裂解疫苗,為國内首家适用于預防相關型别的流感病毒引起的流行性感冒疫苗。2017年-2018年流感流行季出現的大量流感病例,四價流感疫苗的上市為2018年-2019年流感季的預防接種提供了保障。
25.口服I型III型脊髓灰質炎減毒活疫苗(人二倍體細胞),适用于預防脊髓灰質炎I型和III型病毒導緻的脊髓灰質炎。自我國全面停用三價脊髓灰質炎減毒活疫苗後,可用于與脊髓灰質炎滅活疫苗(IPV)序貫接種的二價脊灰減毒活疫苗存在較為嚴重的供應短缺問題,該藥