新聞中心
來源:藥智網/獨活
8月18日,山東新華制藥股份有限公司發布公告:全資子公司鹽酸西替利嗪片(10mg)首家通過仿制藥一緻性評價。受理号:CYHB1850119;原藥品批準文号:國藥準字H19990095。截至7月31日,用于鹽酸西替利嗪片一緻性評價項目研發費用投入約為人民币800萬元。
數據顯示,2016年6月14日,新華制藥(高密)有限公司對鹽酸西替利嗪片進行了參比制劑備案,備案号:2016060355。2017年8月新華制藥(高密)有限公司對鹽酸西替利嗪片進行了BE備案,并在2017年8年6日至2018年1月12日在中國醫科大學附屬盛京醫院開展了科學題目為“鹽酸西替利嗪片随機、開放、單劑量、自身交叉人體生物等效性臨床研究”的BE試驗。2018年07月26日,該産品獲得國家藥品監督管理局藥審中心承辦。

一緻性評價通過情況(包括視同通過)
截止8月19日,通過和視同通過仿制藥一緻性評價品種的受理号達到324個,通過受理号數238個,視同通過86個(以中國上市藥品目錄集為準)。其中289目錄受理号數130個,僅53個品種。
時間維度來看,大緻可以看出2017年12月公布第一批通過一緻性評價的目錄開始(2017年7月和9月那4個受理号為視同通過的品種),每月基本都有通過的品種,在2018年12月達到最多,總計45個受理号。
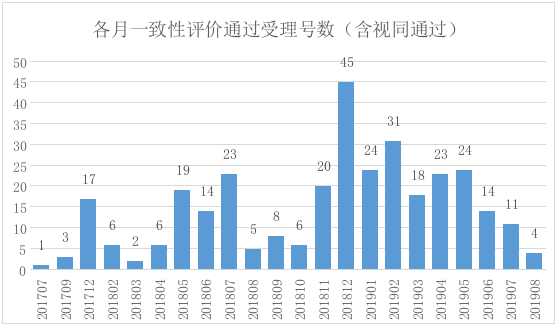
圖1:各月一緻性評價通過受理号數(含視同通過)
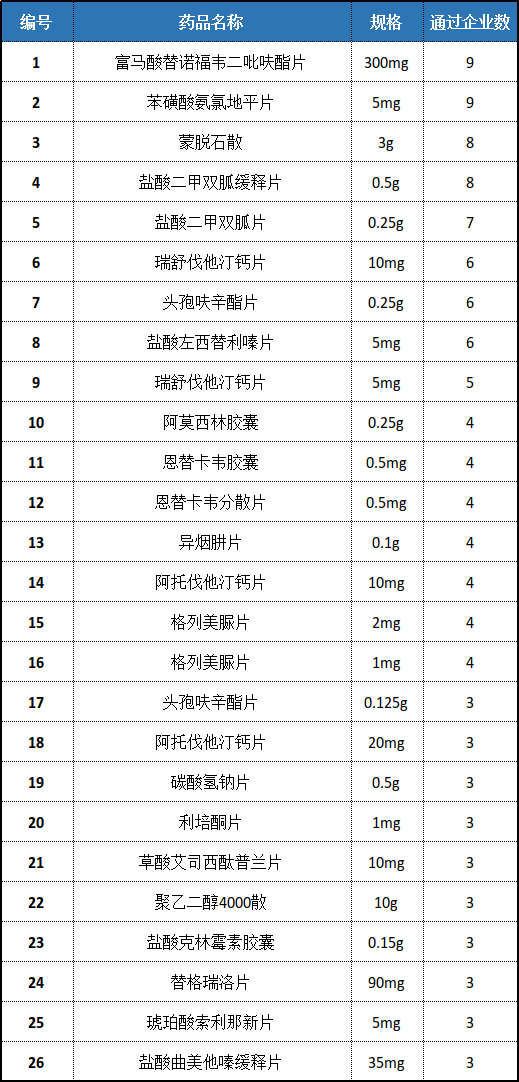
藥品通過方面來說,已有26個品規一緻性評價通過企業數達到3家,包括瑞舒伐他汀鈣片(首個達到3家的品種)、苯磺酸氨氯地平片、蒙脫石散、頭孢呋辛酯片、草酸艾司西酞普蘭片、阿莫西林膠囊、富馬酸替諾福韋二吡呋酯片等。目前通過企業數最多的品規是5mg的苯磺酸氨氯地平片和300mg的富馬酸替諾福韋二吡呋酯片,均達到9個企業,在本次統計中首次達到通過企業數為三家的是琥珀酸索利那新片和鹽酸曲美他嗪緩釋片。
表1:通過企業數達到3家及以上的品種
2018年12月28日,《國家藥品監督管理局關于仿制藥質量和療效一緻性評價有關事項的公告(2018年第102号)》提到了兩個重要的信号:1、對納入國家基本藥物目錄的品種,不再統一設置評價時限要求。2、化學藥品新注冊分類實施前批準上市的含基本藥物品種在内的仿制藥,自首家品種通過一緻性評價後,其他藥品生産企業的相同品種原則上應在3年内完成一緻性評價。
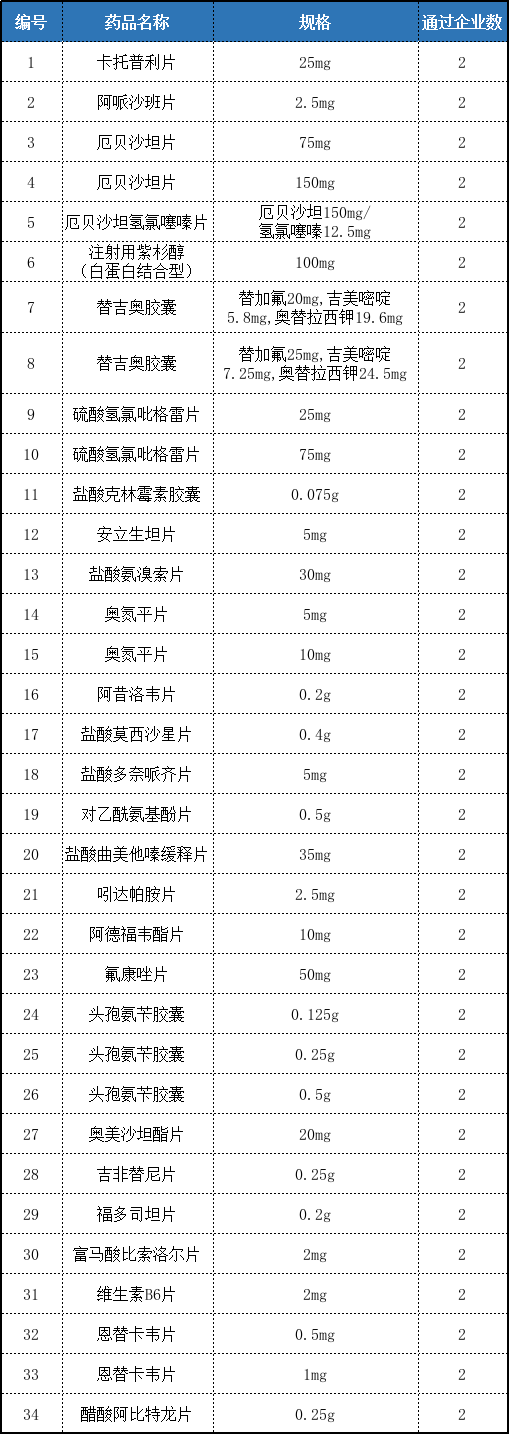
據統計,還有34個品規通過企業數已經達到2家,即将達到三足鼎立之勢。
表2:通過企業數達到2家及以上的品種
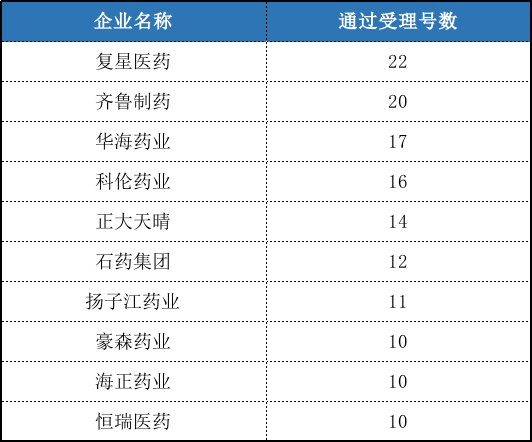
企業方面,通過受理号數量最多的不再是華海藥業,齊魯制藥迎頭趕上,均達到17個受理号;而齊魯制藥通過品種數據最多,達到12個。
表3:企業通過受理号數排名

以母公司計,通過受理号數量最多的複星醫藥,旗下子公司和孫公司通過受理号數合計達到22個;其次是齊魯制藥,達到20個受理号;排名第三的是華海藥業,受理号數達到17個。由于各子公司品種有一定重複,這裡不再統計通過的品種數。
表4:母公司通過受理号數排名
以上數據來源于CDE中國上市藥品目錄集、上市企業公告、藥智數據。
網站免責聲明:
1.湖北海鴻醫藥有限公司對本網站上刊登之所有信息不聲明或保證其内容之正确性或可靠性;您于此接受并承認信賴任何信息所生之風險應自行承擔。湖北海鴻醫藥有限公司,有權但無此義務,改善或更正所刊登信息任何部分之錯誤或疏失。
2.凡本網站注明"來源:XXX(非本網站)"的作品,均轉載自其它媒體,轉載目的在于傳遞更多信息,并不代表本網站贊同其觀點和對其真實性負責。本網轉載其他媒體之稿件,意在為公衆提供免費服務。如稿件版權單位或個人不想在本網站發布,可與本網站聯系,本網站視情況可立即将其撤除。
聯系電話:027-84877900 郵件:1015566216@qq.com